1. 乳腺癌的恶性程度怎么看? 2. 乳腺癌的分期怎么看? 3. 治疗的有效性怎么保证? 患者 我的病能有多少概率治好? 我还能活多久? 影响治愈率的三大因素,关键可以看这三点:恶性程度、疾病分期、和治疗的有效性。 为什么看这三点就可以了?我们可以这样来理解: 如果我们把肿瘤比作罪犯,其中恶性程度代表罪犯的性质,小偷和恐怖分子肯定不一样,它们的破坏性,以及反抗强度也不同。分期就代表罪犯的数量,分期越早,罪犯越少,破坏性也就越小,也越好对付。治疗的有效性代表消灭手段,有效性越高,罪犯被消灭得越彻底。 所以,当我是小偷,并且只有1个,那就可以轻松消灭彻底,治愈率也高。如果我是恐怖分子,并且是10个,那消灭起来就有些费劲,治愈率也就相对来说较低。 那通俗地理解了它们之间的关系以后,我们来看看这三点该怎么去判断。
乳腺癌的恶性程度怎么看?
乳腺癌的病理分级提示乳腺癌的恶性程度,可为临床治疗和预后提供参考。要注意分级和分期是不同的,病理分级是反映肿瘤恶性程度,临床分期反映肿瘤的规模及扩散程度。
一般,肿瘤分级需要根据肿瘤组织的间变程度,包括癌细胞的分化程度、排列方式、核分裂数量及局部浸润程度等加以确定。据此,乳腺癌的组织学分级分为三级:
? Ⅰ级(G1)为分化好,恶性程度低;
? Ⅱ级(G2)为分化中等,恶性程度中度;
? Ⅲ级(G3)为分化差,恶性程度高。
如果单独看一个指标,级别越高表示乳腺癌的恶性程度越高。比如III级的预后相比于I级的预后要更差,从治疗的角度考虑就需要更强的治疗。
但是,如果是不同分期,比如早期三级乳腺癌与晚期一级乳腺癌,这是没办法比较的,谁的生存期更长没办法预估。
可以说,肿瘤的恶性程度是天生的,从得癌那一刻起就注定了,不像分期可以通过早发现来决定,这也是为什么说“同病不同命”。所以,不要看到一个人跟自己病情差不多,她复发了自己就焦虑不已,这些都是没有必要的。
乳腺癌的分期怎么看?
肿瘤临床分期对确定治疗方案和判断病人的预后有意义,通常分期越早预后也相对越好。
美国国立癌症研究所数据库(SEER)的统计数据显示,乳腺癌整体 5 年相对生存率为 90.8%,而早期乳腺癌患者可达 99.3%。[1] 由此可见,诊断时乳腺癌患者分期越早,生存率越高。

注:SEER数据库采用的肿瘤分类不是依据TNM分期,而是SEER分期,分为Localized,Regional和Distant,基本等同于平时大家讲的癌症早期、中期和晚期。
肿瘤的分期代表的是肿瘤在体内的负荷程度,目前大多采用WHO的TNM 分期法,即按原发肿瘤的大小和范围(T),有无区域淋巴结转移(N),有无远处转移(M)等进行综合分期。[2]
① T 是肿瘤大小 随着肿瘤体积的增大、邻近组织受侵范围增加,依次表示为T1~T4。
? Tis:原位癌
? T1:肿瘤最大直径≤2cm
? T2:2cm<肿瘤最大直径≤5cm
? T3:肿瘤最大直径>5cm
? T4:无论肿瘤大小,直接侵犯胸壁或皮肤 (包括炎性乳腺癌)
② N是淋巴结状态 随着淋巴结转移数目和位置的不同,可标注为N0~N3。
? N0:未见区域淋巴结转移
? N1:1~3个腋窝淋巴结转移
? N2:4~9个腋窝淋巴结转移,或仅内乳淋巴结转移
? N3:≥10个淋巴结转移,或有同侧锁骨上/下淋巴结转移
③ M是远处转移 根据有无远处转移标注为M0/M1。
? M0:未见远处转移
? M1:有远处转移
根据上面TNM分期,就可以分为0期、I期、II期、III期、IV期。
早期乳腺癌: 主要包括根据TNM分期为0期、I期、IIA期或IIB(T2N1M0)期的患者。迄今为止尚无明确定义,较为公认的是,早期乳腺癌可望永久性治愈。
局部晚期乳腺癌: 通常来说,指的是从ⅡB期(T3N0M0)~Ⅲ C期(包括未发现有远处转移的炎性乳腺癌)一大类乳腺癌。
也就是人们常说的“中期”,是指乳腺癌在乳房内病变浸润范围广,或同时有较重区域淋巴结受累,但临床未发现有远处转移。
晚期乳腺癌: 指转移性(Ⅳ期)乳腺癌。
治疗的有效性怎么保证?
在这三点影响因素中,分期和恶性程度没有办法改变,唯一可以人工干预的因素就是治疗。什么样的治疗才算最有效的治疗?不是副反应的大小,也不是药物有多贵,而是 第一,你的治疗方案是否是最佳方案;第二,这个方案有没有被严格执行。
治疗方案的正确性
临床上,一般正规有效的治疗方案,都是根据循证医学,参考官方发布的权威指南,需要超指南用药的患者是极少数的。
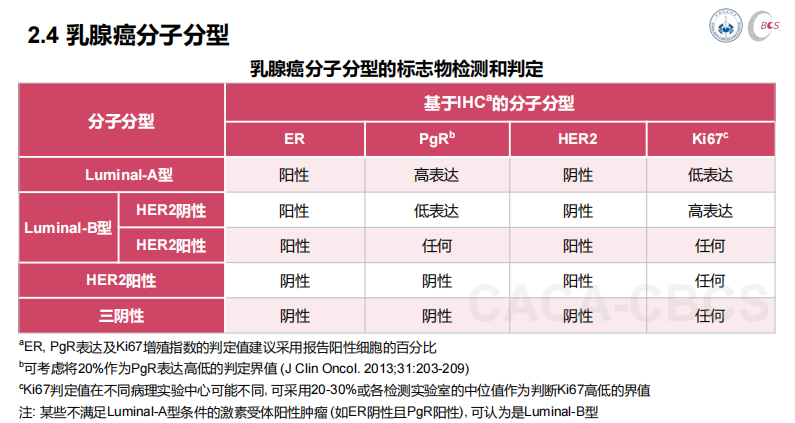
根据《中国抗癌协会乳腺癌诊治指南与规范》,不同的分期、不同病理类型有不同的治疗方式。

Luminal A型乳腺癌:
该分型对内分泌治疗较为敏感,可以采用内分泌治疗±CDK4/6抑制剂靶向治疗。由于HER-2阴性,所以此分型乳腺癌不适合使用抗HER-2靶向治疗。
Luminal B型乳腺癌:
①HER-2是阴性,此分型患者治疗常常采用内分泌治疗±CDK4/6抑制剂靶向治疗。同样,该分型不适合使用抗HER2靶向治疗。
②HER-2是阳性,俗称“三阳”型,由于HER-2阳性,此型患者需要用“抗HER2靶向药物”。因此,治疗上需要在内分泌治疗±CDK4/6抑制剂靶向治疗基础上,再加上抗HER2靶向治疗。
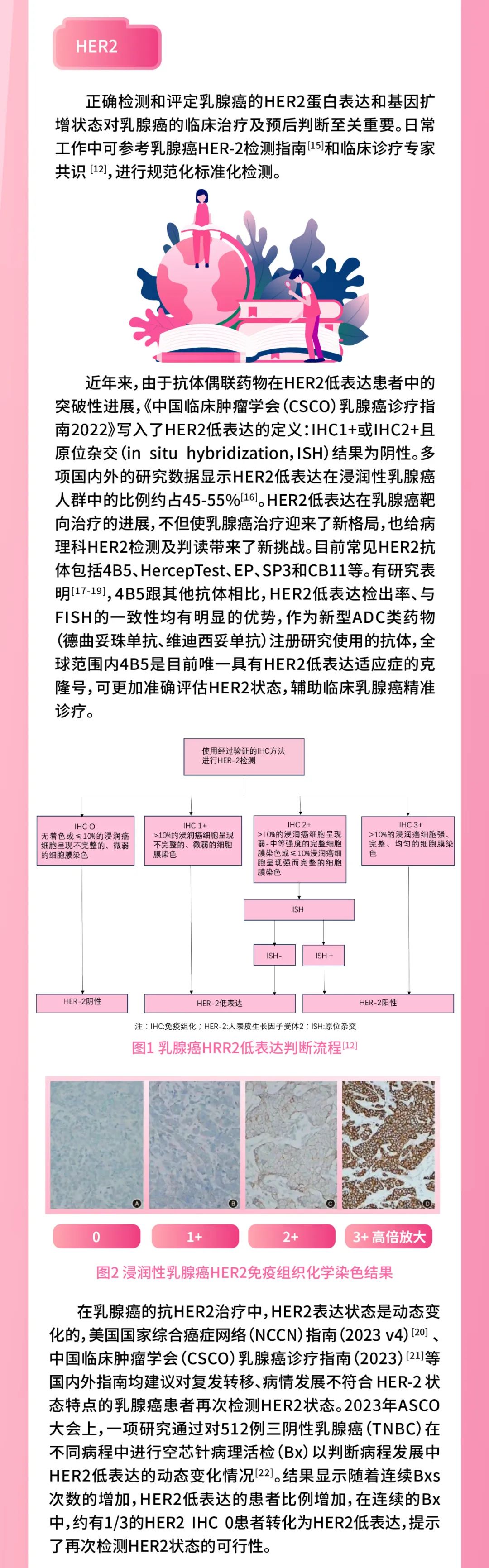
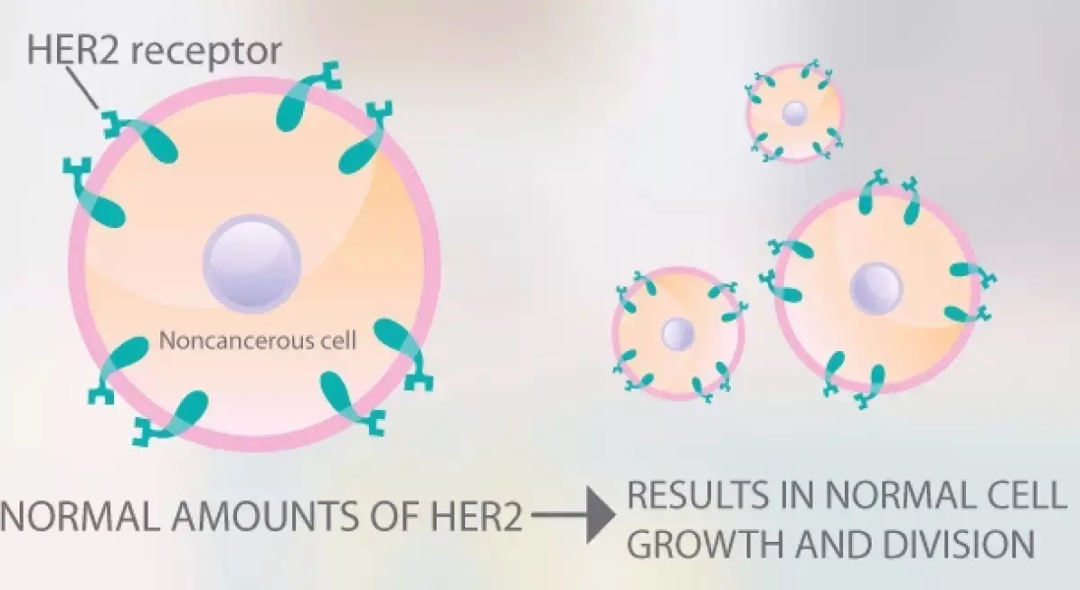
HER-2阳性型乳腺癌:
此型也就是我们常说的需要用“靶向药物”的一大类人(如曲妥珠单抗/帕妥珠单抗等),抗HER2靶向治疗在此分型人群至关重要。
目前HER2治疗的靶向药物主要有三大类,单克隆抗体、 小分子酪氨酸激酶抑制剂(TKI)、以及抗体-药物偶联物(ADC)。
三阴型乳腺癌:
即激素受体(ER、PR)和HER-2均为阴性,该型患者失去了使用内分泌治疗和靶向治疗的机会,药物治疗充分依赖化疗。
此分型具有高侵袭性,其预后较差。但近年来不不少新药相继获批,例如免疫调控点抑制剂如PD-1,PDL-1单抗,BRCA突变患者可以选择PARP抑制剂、以及靶向Trop-2抗体偶联药物如戈沙妥珠单抗等,都为此类型乳腺癌患者带来更多的治疗选择。
注意,以上列举的,都是普遍的一个治疗方法,具体每位患者病情不同,还是要听主治医生的建议。
方案执行的严格性
方案用药都没有问题,但是没有好好坚持治疗,疗效一样会大打折扣。这也就是我们常常强调的,一定要坚持内分泌足疗程,不要随意地断药、换药。
这是因为药物都有自身的药效周期,一段时间过去,药物就会从身体中代谢出去,因此,需要我们持续不断地进行用药,维持体内的药物浓度,身体才能置于药物的保护之下。
据英国苏格兰格拉斯哥大学研究人员在《英国癌症期刊》上报告说,他们对 1263 名乳腺癌患者的处方记录和服药情况进行了跟踪调查,发现一些患者没有按医生要求坚持服用他莫西芬。[3]
研究人员将按期服药率不足80%的患者认定为“对坚持治疗配合度低”,并分析了她们的癌症复发风险。研究显示,未坚持服药的人群癌症复发和死亡风险都更高。
因此,坚持规范服药才能保证治疗的有效性,才有机会获得长期生存。
浙大妇院外科
以乳腺疾病、外科疾病的预防、诊断和治疗为工作重点,收治乳腺良性疾病包括乳腺纤维囊性增生病、乳腺囊肿、纤维腺瘤、导管内乳头状瘤、先天性乳头凹陷及哺乳期积乳症、急慢性乳腺炎等各种乳腺良性疾病的诊治;各期乳腺癌、肉瘤等乳腺恶性疾病的诊断和综合治疗,包括癌前病变的鉴别诊断、乳腺癌的早期诊断以及乳腺癌保乳保腋手术、改良根治术、病灶切除后的乳房重建术等手术治疗与化学治疗、内分泌治疗、靶向治疗等;妊娠期急慢性阑尾炎,腹股沟疝,胃肠道肿瘤,甲状腺结节及周围血管疾病等常见普通外科疾病,尤其是与妇产科相关的合并症、并发症。常规开展乳腺癌保乳手术、前哨淋巴结活检术、乳房切除后重建术;针对乳腺纤维瘤,复杂性乳腺囊肿等多种良性乳腺病灶进行微创手术切除。每年完成上百例乳腺癌保乳及乳房重建手术。
浙大妇院外科一直遵循“微创是乳腺外科发展的方向,坚持疗效、功能与美观相统一”的理念,致力于在解除患者病痛的同时,努力探索通过小切口、隐蔽切口清除病灶,通过组织肌皮瓣转移填充整形、重建乳房等手段最大程度地保证乳房的功能和美观,达到满意的治疗效果。
END
综上,分期越早、恶性程度越低、治疗有效性越高,那么治愈率也就越高。如果自己的分期和分级不理想,那我们就好好治疗,同时提高我们的自身的免疫力,健康生活,也会对我们的康复有所帮助。
再者,我国的乳腺癌诊治水平也不断提高,根据英国顶尖医学杂志《柳叶刀》研究报告显示,2010-2014年我国乳腺癌患者 5 年生存率已提升至83.2%。[4] 所以,大家也不用太过焦虑,让我们一起加油吧!
【 参考资料 】
[1] 美国国立癌症研究所SEER数据库(2013-2019).
[2] 中国抗癌协会乳腺癌专业委员会 . 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31 (10): 954-1040.
[3] McCowan C, Wang S, Thompson AM, et al.The value of high adherence to Tamoxifen in women with breast cancer: a community-based cohort study. Br J Cancer, 2013, 109(5): 1172-1180.[4]Allemani C, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37?513?025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018 Mar 17;391(10125):1023-1075.